미세먼지 성분과 물리적 구조 우리나라 미세 먼지 분석
우리나라 미세먼지의 구성 요소와 물리적 특성에 대해 정리한 글입니다. 자세한 내용은 아래 포스팅을 참고해 주세요.
| 목차 |
| 1. 미세먼지 성분과 물리적 구조 |
| 화학물질 성분 - 물리적 구조 |
| 비고. |
| 공기 청정기 기술 설명 - 삼성 비스포크 큐브 에어 인피니티 라인 → |
미세먼지 성분과 물리적 구조(우리나라 미세 먼지 분석)

미세 먼지는 대기 중에 떠다니는 작은 입자들로, 주로 자동차, 산업 공정, 건물 연소, 그리고 자연적인 원인 등에서 발생합니다.
이러한 입자들은 지름이 10 마이크로미터보다 작은 것으로 정의되며, 대부분은 2.5 마이크로미터 이하로 매우 작습니다. 이러한 미세 먼지는 대기 중에 떠다니면서 호흡기에 침투하여 건강에 해를 끼칠 수 있습니다.
특히, PM2.5(직경 2.5 마이크로미터 이하의 입자)는 호흡기 질환과 심장 질환을 유발할 수 있으며, 장기적으로 건강에 심각한 영향을 줄 수 있습니다. 미세 먼지 농도는 대기 오염 지수로 측정되며 이는 공기 중 미세 먼지 농도를 나타내는 데 사용됩니다.
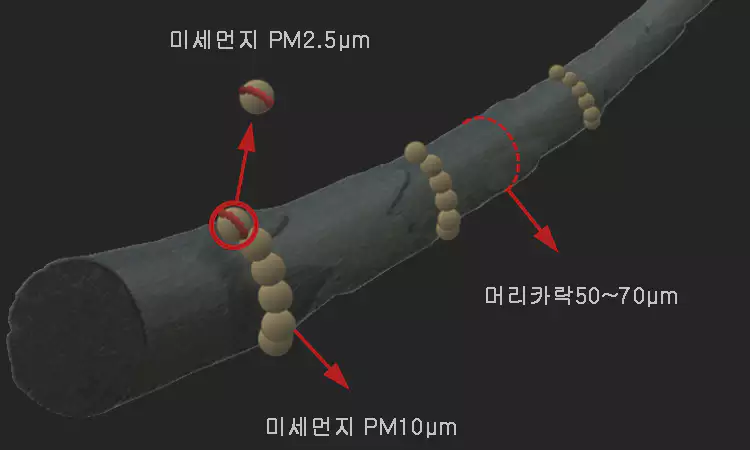
미세먼지는 총 먼지(TSP, Total Suspended Particles)와 미세먼지(PM, Particulate Matter)로 구분됩니다. 미세 먼지는 다시 PM10과 PM2.5로 나뉩니다. PM10은 머리카락 지름보다 약 1/5~1/7 정도의 작은 입자이며, PM2.5는 머리카락의 약 1/20~1/30 크기의 더 작은 입자를 말합니다.
미세먼지는 다양한 화학물질과 물리적 입자로 이루어져 있습니다. 이러한 성분은 먼지가 발생하는 원인과 형성 과정에 따라 달라집니다. 우리나라의 경우, 전국 주요 지역에서 측정되는 미세먼지의 절반 이상이 황산염과 질산염과 같은 대기오염물질로 구성됩니다.
화학물질 성분

황산염(Sulfates): 황산염은 황이 대기 중에서 산화되어 생성됩니다. 이는 주로 화력 발전소, 산업 시설 및 자동차와 같은 연소 공정에서 발생합니다. 황산염은 대기 중의 입자 형태로 존재하며, 대기 중의 미세 입자(PM2.5)에 포함됩니다. 미세 황산염 입자는 호흡기에 침투하여 호흡기 질환을 유발할 수 있습니다.
질산염(Nitrates): 질산염은 질소 산화물(Nitrogen Oxides)과 대기 중의 수증기가 반응하여 생성됩니다. 주요 원인은 자동차 및 산업활동입니다. 질산염도 대기 중의 입자 형태로 존재하며, 미세 입자(PM2.5)에 포함됩니다. 이는 마찰식 호흡기 질환 및 다른 건강 문제와 관련될 수 있습니다.
물리적 구조
앞서 설명한 대로, 대기 오염의 주요 성분으로서 황산염과 질산염은 우리에게 해를 가하지만 한편으로는 화학 산업과 생태계에 매우 중요합니다. 아래에서는 황산염과 질산염의 화학적 성질과 구조에 대해 파헤쳐 보겠습니다.
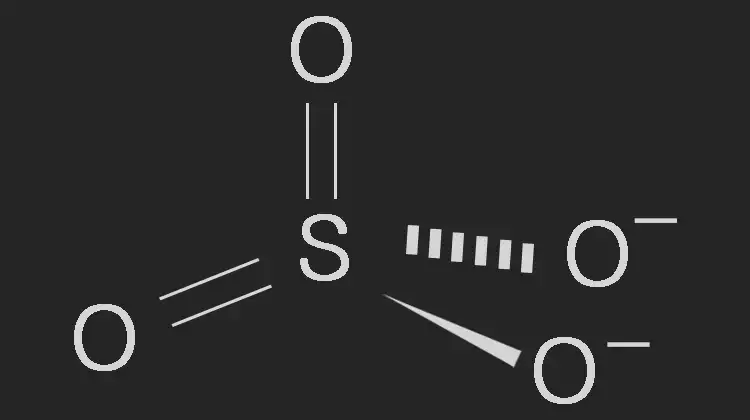
황산염은 황산이온(SO₄²⁻)을 포함하는 화합물로, 납 축전지, 황산구리, 황산마그네슘, 황산칼슘(석고) 등으로 사용됩니다. 아래는 이온의 화학적 성질과 구조에 대한 설명입니다.
황산염은 다양한 산업 및 일상생활에서 다양한 용도로 사용됩니다.
- 비료: 황산 마그네슘(Magnesium sulfate)은 비료로 사용되어 식물에 마그네슘과 황을 공급합니다.
- 식품 첨가제: 황산염은 식품 산업에서 pH 조절제나 항균제로 사용될 수 있습니다.
- 약품: 약학 분야에서는 다양한 의약품에 황산염이 사용됩니다.
- 산업 프로세스: 황산 구리(Copper sulfate)는 산업적으로 중요한 산화제이며, 전기 도금, 산업용 화학물질 생산 등에 사용됩니다.
- 바닷물 정화: 황산 칼슘(Calcium sulfate)은 바닷물 정화 프로세스에서 물질 침전에 사용될 수 있습니다.
황산염 성질
용해도: 대부분의 황산염은 물에 잘 용해되며, 수용액에서 이온화되어 황산이온(SO₄²⁻)과 금속 이온으로 분해됩니다. 이는 황산염이 수용액에서 전기전도도를 가지는 이유입니다.
안정성: 황산염은 대부분 안정된 화합물입니다. 대기 중에서도 상당 기간 안정적으로 존재할 수 있습니다.
화학적 반응: 황산염은 강한 산이 아니기 때문에, 대부분의 금속 및 비금속 화합물과 반응할 때 산화 및 환원 반응이 발생합니다. 또한, 산화제나 환원제로서의 역할을 할 수 있습니다.
황산염 구조
이온 구조: 황산염은 황산이온(SO₄²⁻)과 금속 이온으로 구성됩니다. 황산이온은 황산 분자(SO₄)가 이온화되어 양전하를 가진 이온 형태입니다. 금속 이온과의 전기적인 상호작용에 의해 이온 격자가 형성되며, 이것이 황산염의 구조를 결정합니다.
결정 구조: 황산염의 결정 구조는 다양할 수 있지만, 일반적으로 이온 간의 전기적인 상호작용에 의해 안정된 격자 구조를 형성합니다.
황산염은 물리적 및 화학적으로 안정된 화합물이며, 용해도가 높고 대부분의 금속 및 비금속 화합물과 반응할 수 있습니다.
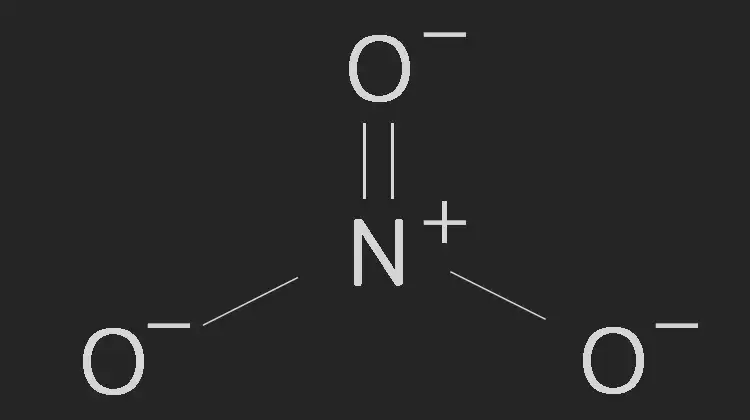
질산염은 질산 이온(NO₃⁻)을 포함하는 화합물로, 화학 산업, 농업, 의약품 제조 등 다양한 분야에서 사용됩니다. 아래는 이온의 화학적 성질과 구조에 대한 설명입니다.
질산염 성질
용해도: 대부분의 질산염은 물에 잘 용해되며, 수용액에서 이온화되어 질산 이온(NO₃⁻)과 금속 이온으로 분해됩니다. 이는 질산염이 수용액에서 전기전도도를 가지는 이유입니다.
안정성: 일반적으로 안정된 화합물로, 대기 중에서 비교적 오랜 기간 동안 안정적으로 존재할 수 있습니다.
화학적 반응: 질산염은 강한 산이 아니기 때문에, 대부분의 금속 및 비금속 화합물과 반응할 때 산화 및 환원 반응이 발생합니다.
질산염 구조
이온 구조: 질산염은 질산 이온(NO₃⁻)과 금속 이온으로 구성됩니다. 질산 이온은 질산 분자(NO₃)가 이온화되어 양전하를 가진 이온 형태입니다. 이온 간의 전기적인 힘에 의해 이온 격자가 형성되며, 이것이 질산염의 구조를 결정합니다.
결정 구조: 질산염의 결정 구조는 다양할 수 있지만, 일반적으로 이온 간의 전기적인 상호작용에 의해 안정된 격자 구조를 형성합니다.
질산염은 물리적 및 화학적으로 안정된 화합물이며, 용해도가 높고 대부분의 금속 및 비금속 화합물과 반응할 수 있습니다.

